Новости
Инфекционные болезни: обзор отечественных публикаций. Сентябрь-2023
Фото из открытого источника (Яндекс-картинки)
-
 03.10.2023
03.10.2023
-
 521
521
Здравствуйте, уважаемые коллеги. Сегодня предлагаем вашему вниманию обзор публикаций отечественных авторов за последние месяцы.
Введение. В последнее время все больше внимания уделяется роли индоламин-2,3-диоксигеназы (IDO) и арилуглеводородного рецептора (AhR) в поддержании баланса между иммунной реактивностью и толерантностью при различных инфекционных заболеваниях. Известно, что отличительной чертой COVID-19 является активация иммуновоспалительных путей, которые индуцируют индоламин-2,3-диоксигеназу – ключевой фермент, катализирующий метаболизм триптофана (TRP) по кинурениновому пути (KYN), тем самым изменяя соотношение кинуренина/триптофана в сыворотке крови больных. Важным свойством SARS-CoV-2 является его способность связываться с арилуглеводородным рецептором, что приводит к увеличению внутриклеточной экспрессии индоламин-2,3-диоксигеназы и продукции кинуренина на начальной стадии инфекции. Длительная активация арилуглеводородного рецептора повышает выработку интерлейкина-6, усиливая воспалительное состояние и противодействуя иммунной толерантности на более поздних стадиях COVID-19. В совокупности эти данные указывают на важную роль индоламин-2,3-диоксигеназы и арилуглеводородного рецептора в контролировании воспаления у пациентов с COVID-19. Нарушение регуляции иммунного ответа не только ставит под угрозу способность хозяина справиться с SARS-CoV-2, но также может предрасполагать человека к вторичным бактериальным и грибковым инфекциям. Среди вторичных инфекций, которые возникают у пациентов с новой коронавирусной инфекцией, COVID-19-ассоциированный инвазивный аспергиллез легких является важной причиной смертности, хотя многие аспекты болезни все еще остаются нерешенными.
Основная часть. В данном обзоре освещены современные представления о значении метаболитов триптофана и иммунологических факторов в патогенезе COVID-19 и инвазивного аспергиллеза легких. Предполагается, что SARS-CoV-2 при легком или субклиническом течении заболевания активирует путь IDO/KYN/AhR, препятствующий развитию гипервоспалительного иммунного ответа, в то время как при тяжелых формах COVID-19 активируется воспалительная петля AhR/IL-6/STAT3/AhR, поддерживающая хронический воспалительный процесс, что, вероятно, способствует присоединению оппортунистических инфекций. Необходимо дальнейшее исследование роли IDO и AhR в патогенезе COVID-19 и вторичных инфекций, таких как COVID-ИА. Избирательное воздействие на метаболические и иммунологические пути, нарушенные у пациентов с COVID-19, может быть перспективным методом восстановления защитного иммунного ответа и снижения восприимчивости к грибковой инфекции.
Заключение. Изучение иммунологических показателей, наряду с измерением соотношения KYN/TRP и клинических параметров, имеет важное значение для выявления ранних нарушений иммунных механизмов и своевременного терапевтического вмешательства. Подбор новых терапевтических мишеней коррекции иммунного ответа может стать основой превентивных подходов как контроля воспаления при тяжелой вирусной пневмонии, так и разработки новых стратегий лечения микотических осложнений.
Введение. Своевременная диагностика иксодового клещевого боррелиоза (ИКБ) является залогом его успешного лечения. Амбулаторное наблюдение за пациентами после присасывания клеща на основе алгоритма способно оптимизировать раннюю диагностику ИКБ, повысить выявляемость заболевания и сократить сроки начала лечения.
Цель работы — создание алгоритма наблюдения и обследования пациентов после присасывания клеща для применения в амбулаторных условиях врачами первичного звена здравоохранения.
Материалы и методы. Проведено ретроспективное, нерандомизированное, одноцентровое когортное исследование, основанное на анализе данных 660 амбулаторных карт пациентов, проконсультированных врачом-инфекционистом на базе ГБУЗ «ИКБ №1 ДЗМ» в связи с присасыванием клеща и/или подозрением на ИКБ. Пациенты были разделены по возрасту и наличию или отсутствию диагноза ИКБ. Подтверждение диагноза осуществлялось по клинико-анамнестическим и/или лабораторным критериям с использованием методов иммуноферментного анализа и иммунного блота.
Результаты. Оптимальные сроки определения антител к боррелиям методом иммуноферментного анализа составили 7 и более недель от присасывания и 4 и более недель от появления симптомов. Проведена оценка специфичности иммунологической диагностики у пациентов с исключенным ИКБ. Доля сомнительных и ложноположительных результатов у таких пациентов оказалась высока — 28,1%. Ложноположительные результаты чаще встречались у взрослых (37,6%) по сравнению с детьми (9,8%), за счет более частых ложноположительных результатов выявления IgM (34,1% и 4,9% соответственно). Разработан алгоритм наблюдения за пациентами после присасывания клеща в амбулаторных условиях:
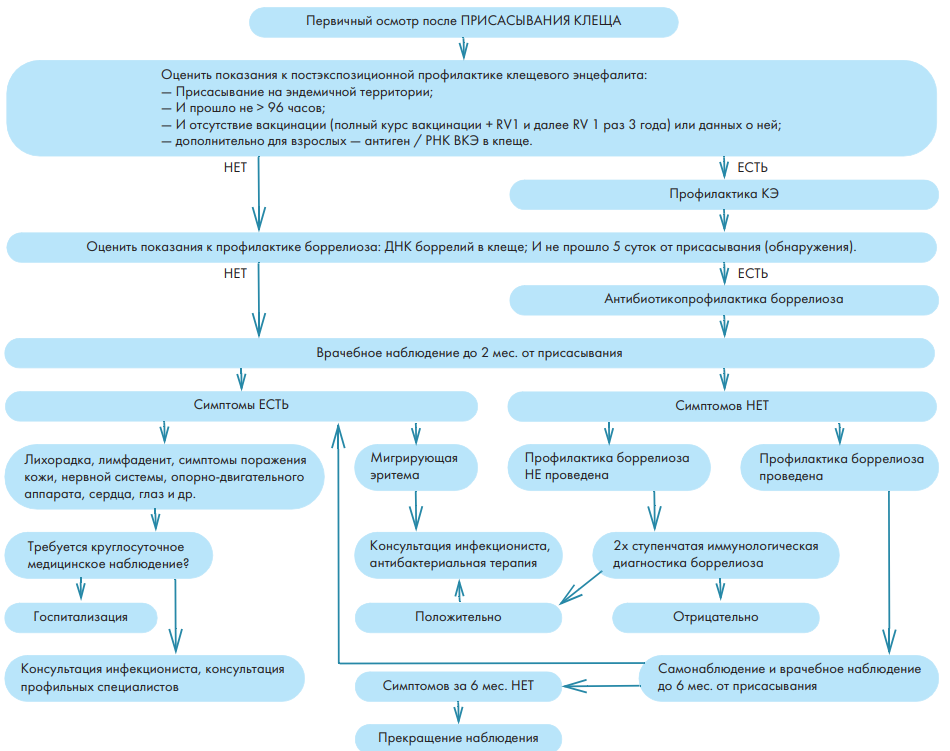
Выводы:
- Инкубационный период (от обнаружения присосавшегося клеща до появления мигрирующей эритемы) у пациентов с ИКБ составил в среднем 13 дней, но в 15% случаев может превышать 4 недели.
- В амбулаторно-поликлинических условиях пациенты с ранней локализованной стадией ИКБ встречались наиболее часто (78,4%). При этом, в подавляющем большинстве случаев основным клиническим проявлением этой стадии, как у детей, так и у взрослых, была мигрирующая эритема (94,6%).
- На 4—6 неделе после присасывания клеща антитела класса IgM и/или IgG методом ИФА обнаруживались лишь в 76% случаев; начиная с 7 недели от начала заболевания, — в 93% случаев.
- У детей с исключенным ИКБ по сравнению со взрослыми статистически значимо реже встречались ложноположительные результаты определения IgM методом ИФА (p < 0,001).
Цель исследования – анализ резистентности ВИЧ-1 к антиретровирусным препаратам первой линии у ВИЧ-инфицированных на фоне применения схем антиретровирусной терапии (АРТ) с различным генетическим барьером к лекарственной устойчивости.
Материал и методы. Выполнено обследование 271 больного с диагнозом «ВИЧ-инфекция» на разных стадиях заболевания, в возрасте от 21 года до 59 лет, наблюдавшихся в 2018–2022 гг. в Центре по профилактике и борьбе со СПИД в составе ГБУЗ НСО «ГИКБ № 1» г. Новосибирска и получавших АРТ. Критерии включения пациентов в исследование: выявленная вирусологическая неэффективность на фоне ранее проводимой успешной АРТ препаратами первой линии, когда в течение 3–6 мес регистрировался неопределяемый уровень вирусной нагрузки РНК ВИЧ. Выполнен ретроспективный анализ степени приверженности пациентов АРТ по следующим критериям: отсутствие пропусков приема препарата – высокая степень приверженности; однократные пропуски – средняя; прерывание схемы лечения более чем на 7 дней – низкая. У всех больных оценивали пути инфицирования ВИЧ, показания к обследованию, принадлежность к группам риска заражения. На базе ФБУН ГНЦ ВБ «Вектор» проведено исследование ВИЧ-1 на лекарственную устойчивость и генотипирование.
Результаты. По совокупности всех зарегистрированных мутаций ВИЧ-1 резистентные варианты выявлены у 148 (54,6%) из 271 больных с вирусологической неудачей АРТ. Чаще других регистрировали сочетание мутаций к препаратам из группы нуклеозидных (НИОТ) и ненуклеозидных ингибиторов обратной транскриптазы (ННИОТ) – в 89 (60,1%) из 148 случаев. Наиболее устойчивыми к развитию мутаций ВИЧ-1 оказались схемы: TDF + 3TC + LPV/r – 4 (9,8%) из 41 случая резистентности и TDF + 3TC + DTG – 8 (16,7%) из 48 случаев, что ниже, чем в группах с ABC + 3TC + EFV и TDF + 3TC + EFV (p<0,05).
У 237 больных проведено генотипирование ВИЧ-1, выявлены 4 генетических варианта: субтип A (14,7%), субтип B (1,3%), CRF63_02A (81,9%) и рекомбинантные варианты, образованные с участием субтипа А и CRF02_AG (1,7%), CRF03_AB (0,4%). Резистентные варианты ВИЧ-1 чаще встречались у инфицированных CRF63_02A – 121 (62,4%) из 194 по сравнению с другими генотипами вируса – 10 (23,3%) из 43 (p<0,001). Все выявленные случаи резистентности к препаратам из группы ингибиторов протеазы и интегразы были зарегистрированы только для CRF63_02A6 ВИЧ-1.
Заключение. Установлено широкое распространение в Новосибирской области рекомбинантного ВИЧ CRF63_02A (81,9%) среди ВИЧ-инфицированных с вирусологической неэффективностью АРТ. Показана высокая частота регистрации мутаций резистентности при этом генетическом варианте ВИЧ-1 (62,4%) по сравнению с другими вариантами (23,3%). В связи с этим требуется проведение обследования для определения резистентности ВИЧ у пациентов с вирусологической неудачей на фоне АРТ. Рекомендовано внедрение скрининга первичной лекарственной устойчивости ВИЧ у пациентов из групп риска с учетом уровня приверженности АРТ.
Введение. Актуальность проблемы висцерального лейшманиоза (ВЛ) обусловлена тяжестью клинических проявлений, а также необходимостью незамедлительного проведения этиотропной терапии.
Целью работы является обобщение имеющихся в литературе данных, касающихся эпидемиологической ситуации по висцеральному лейшманиозу в Республике Армения, с учетом возможности появления завозных случаев на территории РФ.
Материалы и методы: проведен обзор отечественной и зарубежной литературы за последние 10 лет, в том числе, Интернет-ресурсов и приведено собственное клиническое наблюдение за ребенком с завезенным из Армении висцеральным лейшманиозом, протекавшим с рецидивом.
Основная часть. Авторами наблюдался мальчик первого года жизни, постоянно проживающий в Москве, однако выезжавший в Армению летом 2022 года (июль-август), после чего спустя полгода в феврале 2023 года у него появилась лихорадка, гепатоспленомегалия, панцитопения, т.е. типичные для ВЛ симптомы. Эпидемиологические данные, в том числе инкубационный период полностью укладывались в характерный для ВЛ симптомокомплекс. Для исключения тяжелой гематологической патологии, требующей специфической терапии, и подтверждения диагноза ВЛ была проведена костномозговая пункция. В пунктате костного мозга обнаружены амастиготы лейшманий, что позволило поставить окончательный диагноз ВЛ. В соответствии с современными представлениями, лечение ВЛ должно проводится препаратами амфотерицина В, причем безусловное предпочтение следует отдавать липидассоциированным формам последнего.
Курс терапии липосомальным амфотерицином В (Амфолипом) у нашего пациента сопровождался исчезновением лихорадки, улучшением общего состояния ребенка, а также тенденцией к нормализации гематологических показателей. Однако, затем у ребенка отмечено возникновение рецидива. Из возможных факторов риска у данного пациента подходил возраст и персистирующая спленомегалия. Планировалось повторное лечение ребенка липосомальным амфотерицином В, но родителями было принято решение проводить дальнейшую терапию в Армении.
Заключение. Висцеральный лейшманиоз является эндемичным для Закавказья, в т.ч. для Республики Армения, заболеванием. Лица, посещавшие территории высокого риска заражения с развившимся характерным симптомокомплексом, включающим лихорадку, гепатоспленомегалию, панцитопению, подлежат обследованию на висцеральный лейшманиоз. После проведенного лечения необходимо осуществлять динамическое наблюдение.
Наш обзор завершен. До новых встреч.

